利用(yòng)小(xiǎo)分(fēn)子化合物(wù)靶向降解蛋白质(zhì)是药物(wù)研发领域的新(xīn)兴策略,使很(hěn)多(duō)传统方法难以靶向的药物(wù)靶点得以开发,开拓了新(xīn)的靶点和药物(wù)蓝图。靶向降解蛋白质(zhì)的策略除了近几年非常火热的PROTAC药物(wù)以外,分(fēn)子胶(molecular glues)越来越受到关注。相比于PROTAC,分(fēn)子胶在成药性和应用(yòng)范围方面更具(jù)优势,國(guó)内外多(duō)家创业公(gōng)司也相继成立。
在8月7日的活动上,我们邀请到上海科(kē)技(jì )大學(xué)仓勇教授,对分(fēn)子胶在靶向降解蛋白质(zhì)的应用(yòng)进行详细的介绍和深度的分(fēn)析,从技(jì )术发展背景、科(kē)學(xué)深度讲解、策略优势对比、國(guó)内外學(xué)术和公(gōng)司发展动态等多(duō)方面展开讨论。

仓勇教授
上海科(kē)技(jì )大學(xué)研究员、Degron Therapeutics创始人
仓勇,现為(wèi)上海科(kē)技(jì )大學(xué)生命科(kē)學(xué)与技(jì )术學(xué)院研究员,从事癌症免疫遗传學(xué)和蛋白泛素化调控方向的研究。其实验室利用(yòng)分(fēn)子生物(wù)學(xué)手段和细胞/小(xiǎo)鼠模型来研究蛋白泛素化调控及其在发育和疾病生成中(zhōng)的作(zuò)用(yòng), 同时也探索小(xiǎo)分(fēn)子化合物(wù)劫持泛素连接酶用(yòng)于治疗癌症和调节免疫功能(néng)的机制。其创立的上海达歌生物(wù)医(yī)药有(yǒu)限公(gōng)司致力于新(xīn)型分(fēn)子胶药物(wù)的发现和临床推进。仓勇获得复旦大學(xué)生物(wù)化學(xué)學(xué)士,爱因斯坦医(yī)學(xué)院分(fēn)子遗传學(xué)博士,在哥(gē)伦比亚大學(xué)医(yī)學(xué)中(zhōng)心霍华德(dé)休斯实验室完成博士后,曾担任伯罕医(yī)學(xué)研究所助理(lǐ)教授和浙江大學(xué)生命科(kē)學(xué)研究院教授。
目 录 l PROTAC技(jì )术能(néng)突破传统占位抑制(occupancy-based)小(xiǎo)分(fēn)子的局限 l PROTAC相比传统小(xiǎo)分(fēn)子抑制剂的优势 l PROTAC存在以下几方面的挑战 l 分(fēn)子胶的发现 l 分(fēn)子胶和PROTAC比较 l 仓勇和Degron Therapeutics |
PROTAC(proteolysis-targeting chimera,蛋白降解靶向嵌合體(tǐ))技(jì )术利用(yòng)生物(wù)體(tǐ)内固有(yǒu)的泛素-蛋白酶體(tǐ)的降解途径来实现对靶蛋白的降解。PROTAC的概念在2001年左右被提出,其中(zhōng)主要的提出者包括耶鲁大學(xué)的Craig Crews教授,他(tā)也最早创办(bàn)了以PROTAC技(jì )术為(wèi)基础的公(gōng)司Arvinas,最近辉瑞和Arvinas 也达成了24亿美金的合作(zuò)。
PROTAC技(jì )术能(néng)突破传统
占位抑制(occupancy-based)小(xiǎo)分(fēn)子的局限
l 長(cháng)期系统给药造成的耐药突变(原有(yǒu)小(xiǎo)分(fēn)子不再有(yǒu)效)
l 小(xiǎo)分(fēn)子抑制后导致蛋白代偿表达(compensatory target protein expression)
l 部分(fēn)靶点无明显的药物(wù)口袋
l 不可(kě)成药(undruggable)靶点,尤其是一些起支架作(zuò)用(yòng)和调控作(zuò)用(yòng)的蛋白
PROTAC本身实际上是一个杂合双功能(néng)小(xiǎo)分(fēn)子化合物(wù),它能(néng)将靶蛋白和E3泛素连接酶拉近距离,E3将多(duō)个泛素与靶蛋白共价结合,激活泛素-蛋白酶體(tǐ)系统来逐步降解靶蛋白。為(wèi)了实现靶蛋白降解,需要形成靶蛋白-PROTAC-E3连接酶三元复合物(wù),因此PROTAC分(fēn)子的三个组成部分(fēn)也显而易见:靶蛋白的特异性配體(tǐ)、E3泛素连接酶的特异性配體(tǐ)、和链接子(linker),如图1所示。
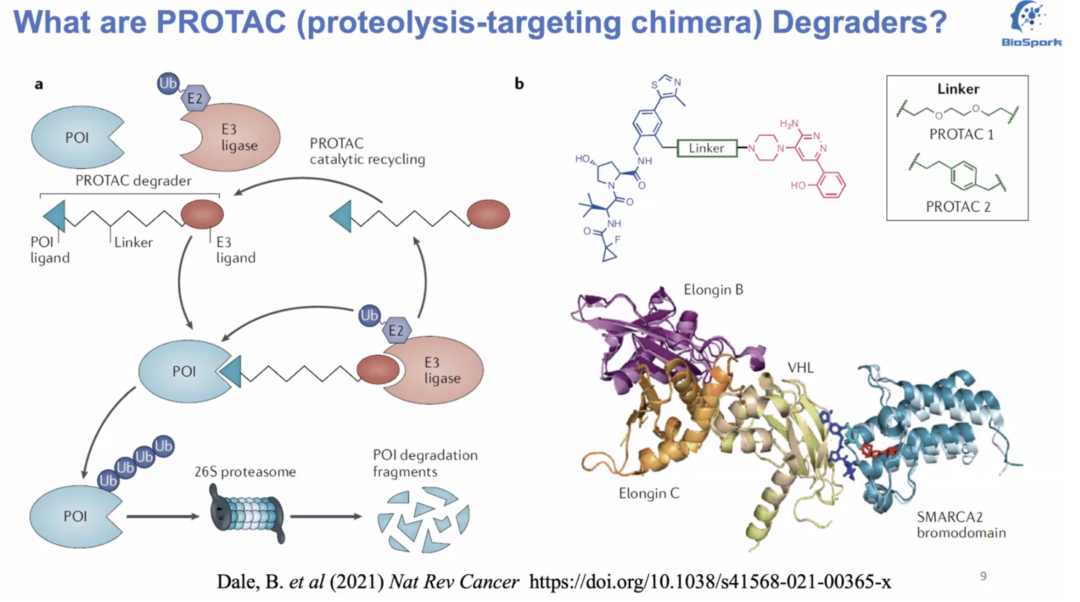
图1. PROTAC化合物(wù)
PROTAC相比传统小(xiǎo)分(fēn)子抑制剂的优势
l 改变蛋白的新(xīn)生降解过程而非占位抑制
l 直接抑制目标蛋白的催化和支架等功能(néng)
l 克服小(xiǎo)分(fēn)子耐药突变
l 能(néng)靶向部分(fēn)不可(kě)成药的靶点
l 独特的靶点选择性和药代动力學(xué)表现
由于PROTAC需要涵盖三个组分(fēn),其分(fēn)子量自然比较大。
PROTAC存在以下几方面的挑战
l 与药物(wù)化學(xué)的里宾斯基五规则(Lipinski’s Rule of Five)不符
l 合成上存在一定挑战
l 體(tǐ)内代謝(xiè)和有(yǒu)效性也有(yǒu)待进一步验证
PROTAC技(jì )术的产(chǎn)品在临床上最快的是Arvinas公(gōng)司的,基本完成概念验证(POC),正在进行二期临床试验。目前很(hěn)多(duō)PROTAC的公(gōng)司设计和筛选PROTAC的分(fēn)子,是通过基于对其三个组分(fēn)库(靶蛋白的特异性配體(tǐ)、E3泛素链接酶的特异性配體(tǐ)、链接子)的拼接、筛选来寻找潜在的PROTAC分(fēn)子。
PROTAC领域的公(gōng)司除了Arvinas,还有(yǒu)Kymera、C4、Vividion、Nurix等。
与PROTAC不同的是,分(fēn)子胶有(yǒu)分(fēn)子量小(xiǎo)很(hěn)多(duō),化學(xué)机构更简单,空间干扰少(relaxed steric interference)和成药性更好的特点。分(fēn)子胶不是一个小(xiǎo)的PROTAC,而是通过诱导或稳定(增强)E3泛素连接酶和靶蛋白之间的蛋白相互作(zuò)用(yòng)(相互作(zuò)用(yòng)需达到一定的稳定程度),来实现对靶蛋白的降解,有(yǒu)点像“双面胶”;在一些情况下,分(fēn)子胶甚至不会单独和靶蛋白或者E3泛素连接酶有(yǒu)任何的作(zuò)用(yòng)。但毋庸置疑的是,分(fēn)子胶无法像PROTAC那样通过对各组分(fēn)的大规模筛选来实现,它的设计会比PROTAC难很(hěn)多(duō)。
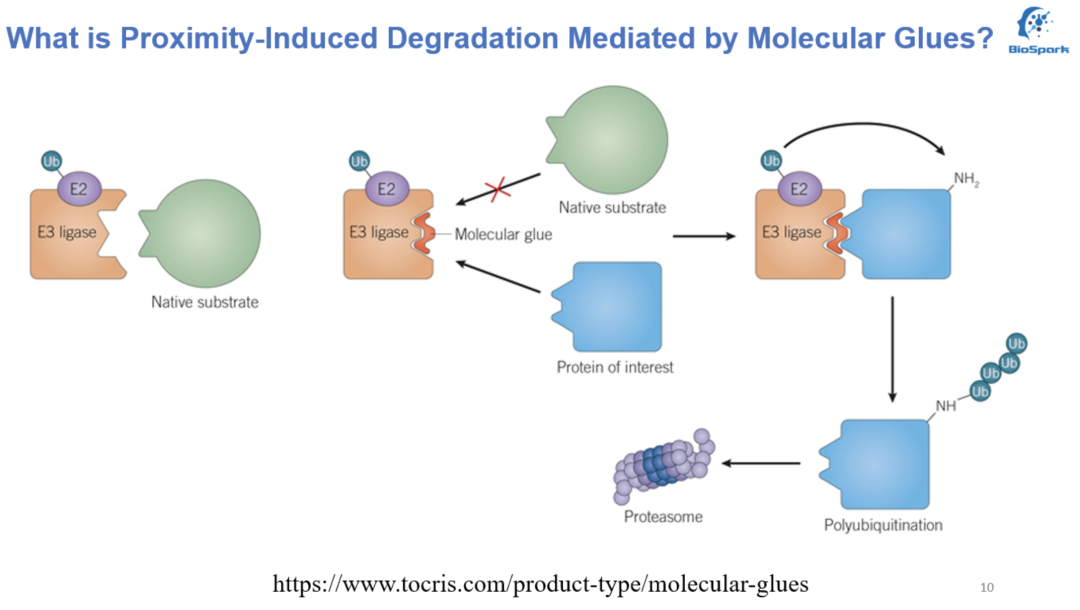
图2. 分(fēn)子胶化合物(wù)
分(fēn)子胶的发现
最早发现的分(fēn)子胶化合物(wù)是一类具(jù)有(yǒu)免疫调节功能(néng)的小(xiǎo)分(fēn)子IMiDs (Immunomodulatory drugs),其代表性药物(wù)是新(xīn)基公(gōng)司(Celgene)的沙利度胺(Thalidomide)、来那度胺(Lenalidomide)和泊马度胺(Pomalidomide)。这几个分(fēn)子都在作(zuò)用(yòng)机理(lǐ)不明时被FDA批准,用(yòng)于治疗各类肿瘤。多(duō)年后的研究发现,这类化合物(wù)是分(fēn)子胶(图2),他(tā)们通过CRBN(cereblon,CRL4泛素酶复合體(tǐ)的一个组成元素)结合,进一步募集了转录因子IKZF1/3,最终导致IKZF1/3的降解。科(kē)學(xué)家们还发现了这类IMiD的衍生物(wù)CC-885——它既可(kě)以结合CRBN,然后募集了转录终止因子(transcription termination factor)GSPT1,在CC-885的基础上做了结构活性关系(SAR)的改进,现在由并購(gòu)了新(xīn)基公(gōng)司后的施贵宝公(gōng)司(BMS)推进临床1期试验阶段的CC-90009正是基于CC-885的化合物(wù)。
另一类化合物(wù)是Acryl sulfonamide类别的,主要的代表有(yǒu)Indisulam、 CQS和Tasisulam。这类化合物(wù)曾一度推进到三期临床试验阶段,但因效果不佳被终止研发。直到2017年发现,这类化合物(wù)通过结合DCAF15(DCAF15和DDB1结合,DDB1和CUL4结合)和RNA剪接因子(splicing factor) RBM39,并最终实现RBM39降解。由于癌细胞中(zhōng)DCAF15过度表达,因此Sulfonamide类化合物(wù)在一定的浓度下,可(kě)以通过靶向癌细胞的DCAF15从而降解必须基因(essential gene) RBM39,致使癌细胞凋亡。这类化合物(wù)是比较特殊的,他(tā)们对于DCAF15和RBM39各自都没有(yǒu)亲和性,它是真正意义上实现了一个“双面胶”的功能(néng),仅在特定的环境下同时和两个蛋白共同结合。
在2020年,有(yǒu)三个实验室分(fēn)别独立地发现了另一类分(fēn)子胶化合物(wù)。这类化合物(wù)在结合CDK12的时候形成了一个界面,能(néng)再结合DDB1,诱导CDK12的底物(wù)Cyclin K的降解(图3)。
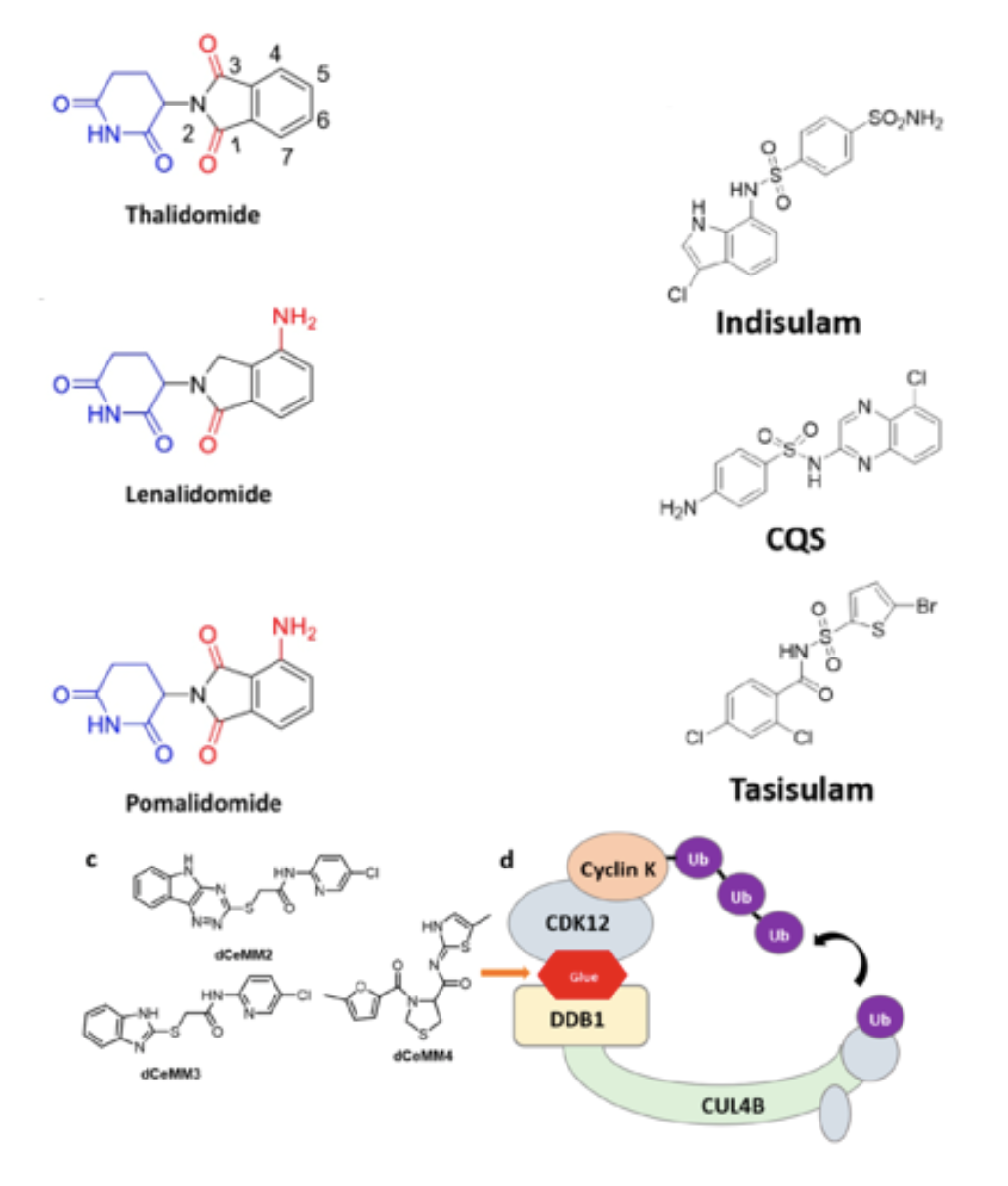
图3. 各类分(fēn)子胶化合物(wù)
分(fēn)子胶和PROTAC比较
值得一提的是,PROTAC的选择性很(hěn)强,它也可(kě)以通过模块式(modular)的方式对其每一个组分(fēn)进行筛选,所以很(hěn)多(duō)的PROTAC公(gōng)司的核心团队以化學(xué)家出身占多(duō)数。分(fēn)子胶则不同,它无法用(yòng)化學(xué)方法直接设计,它的设计挑战极大。迄今為(wèi)止,多(duō)数的分(fēn)子胶还是通过意外发现(serendipity)的方式被大家所发现和确认。
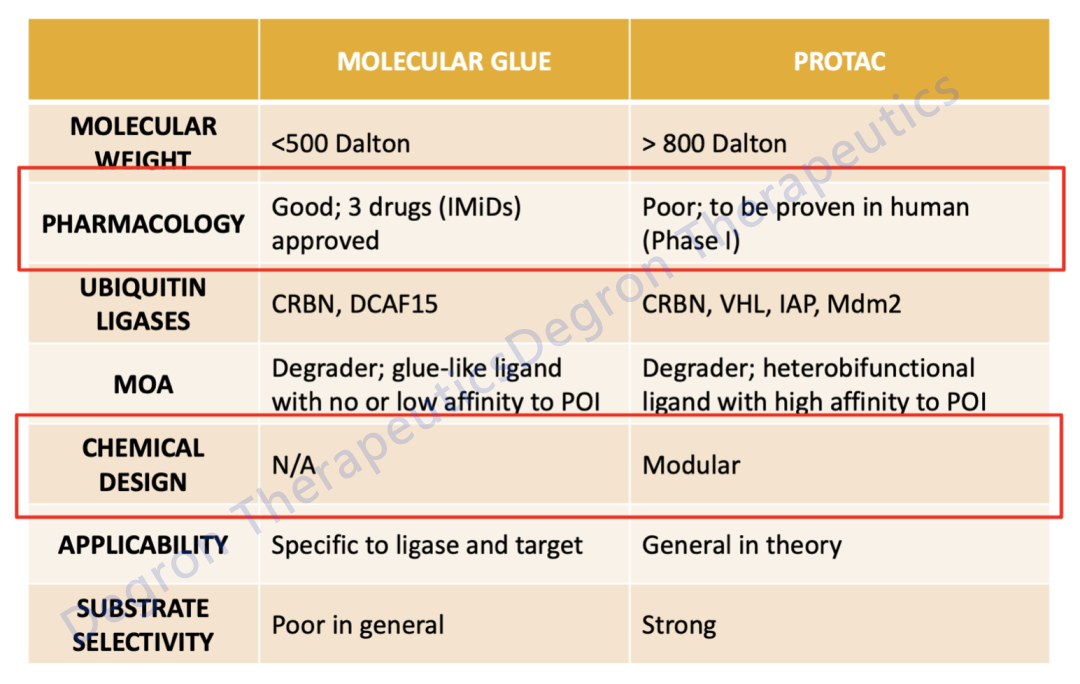
图4. 分(fēn)子胶和PROTAC比较
仓勇和Degron Therapeutics
仓教授此前在Burnham、浙江大學(xué)以及现在上海科(kē)技(jì )大學(xué)的实验室,都是研究E3泛素连接酶的,尤其是CRL4 泛素连接酶对不同底物(wù)的泛素化来调控发育和疾病的机制。基于CRL4底物(wù)受體(tǐ)蛋白CRBN的研究,仓教授也着手对分(fēn)子胶水化合物(wù)降解癌症相关蛋白降解的展开了探索。
CRBN中(zhōng)存在一个由三个Tryptophan形成的很(hěn)浅的口袋,而这个口袋可(kě)以结合glutarimide(多(duō)数IMiD化合物(wù)都具(jù)备的一个结构),在IMiD化合物(wù)和这个口袋结合后,其突出的化學(xué)基团和CRBM结合口袋周围氨基酸残基,会共同组成一个新(xīn)的结构界面(neomorphic CRBN-Glue surface) ,正是这个结构募集了IKZF1/3。基于这些想法,仓勇教授的团队合成了以glutarimide為(wèi)核心的化合物(wù)库,通过生物(wù)表型筛选的方法来定向寻找潜在的其他(tā)分(fēn)子胶化合物(wù)。
目前仓教授的团队筛选出来了一个能(néng)诱导WEE1降解的分(fēn)子胶化合物(wù)。通过化學(xué)竞争(chemical competition)、热稳定性、细胞生物(wù)學(xué)等多(duō)种实验确认了该化合物(wù)的分(fēn)子胶特性。相比之下,阿斯利康目前在临床试验阶段的WEE1抑制剂AZD1775除了能(néng)抑制WEE1还会抑制PLK1,特异性不优,或有(yǒu)潜在副作(zuò)用(yòng)。除了特异降解WEE1的分(fēn)子胶之外,仓教授的团队陆续又(yòu)找到了靶向癌症和代謝(xiè)疾病相关蛋白的其他(tā)分(fēn)子胶化合物(wù)。基于这些,2020年仓教授从上科(kē)大spin off创立了达歌生物(wù)(Degron Therapeutics),致力于分(fēn)子胶水药物(wù)的发现。
仓教授认為(wèi),目前分(fēn)子胶是比较难直接通过化學(xué)设计的方法实现的。与此同时,Degron Therapeutics也在做一些主动的尝试,希望通过对已知靶点(底物(wù))的分(fēn)子胶和底物(wù)探究,来拓展和加深对分(fēn)子胶领域的理(lǐ)解。
致力于分(fēn)子胶药物(wù)发现的公(gōng)司还有(yǒu)Monte Rosa Therapeutics和Neomorph Therapeutics。

问答(dá)精(jīng)选
01 在分(fēn)子胶药物(wù)发现的过程中(zhōng),是否考虑到合成致死的相关机制?比如像WEE1的分(fēn)子胶。
l 有(yǒu)考虑到合成致死相关的因素,因此WEE1抑制剂(或分(fēn)子胶)也会考虑和很(hěn)多(duō)化疗药物(wù)或靶向药物(wù)联用(yòng)。
02 在分(fēn)子胶或者PROTAC的靶向蛋白发生特定的突变,是否也会导致像小(xiǎo)分(fēn)子抑制剂一样因耐药而失效?
l 到目前為(wèi)止,在临床试验阶段的PROTAC药物(wù)还没有(yǒu)看到它造成耐药突变。但在體(tǐ)外试验发现,如果E3泛素连接酶和相关调控蛋白发生了突变,会导致分(fēn)子胶和PROTAC失效。需要强调的是,分(fēn)子胶或者PROTAC和小(xiǎo)分(fēn)子抑制剂导致耐药的机理(lǐ)并不相同。
03 分(fēn)子胶的可(kě)修改的空间小(xiǎo),是否会有(yǒu)一些限制和不足?
l 的确是这样。但这一方面说明传统的化學(xué)方法来设计分(fēn)子胶不是最佳的方式;另一方面,也有(yǒu)一些在分(fēn)子胶方面的改造是有(yǒu)据可(kě)循的。因此,现在也希望通过大数据的方式去尝试找到规律。
04 分(fēn)子胶选择性低,如何做好临床前的评价?
l 对于基于CRBN的分(fēn)子胶,可(kě)能(néng)需要在临床前实验中(zhōng)使用(yòng)CRBN敲入的动物(wù)模型。
05 在可(kě)以靶向(druggable)的蛋白靶点,传统小(xiǎo)分(fēn)子抑制剂和分(fēn)子胶孰优孰劣?
l 仓教授认為(wèi)传统小(xiǎo)分(fēn)子和分(fēn)子胶是一个互补的关系。比如一些传统小(xiǎo)分(fēn)子在長(cháng)期使用(yòng)后,患者體(tǐ)内产(chǎn)生相关耐药突变致使传统小(xiǎo)分(fēn)子不再有(yǒu)效,这种时候如果分(fēn)子胶靶向的蛋白界面和传统小(xiǎo)分(fēn)子不同,就可(kě)以起到互补的作(zuò)用(yòng)——分(fēn)子胶替代传统小(xiǎo)分(fēn)子的使用(yòng)。
06 分(fēn)子胶十分(fēn)依赖于IMiD的靶向蛋白(底物(wù))结构,未来如何扩张分(fēn)子胶的多(duō)样性。
l 这要希望能(néng)找到像CRBN一样的非必须(non-essential)的E3泛素连接酶和与其结合的IMiD类的化合物(wù)。在这类E3泛素化酶里最好能(néng)有(yǒu)一个特别的口袋,在巧妙地结合分(fēn)子胶的同时让残基形成一个新(xīn)的结合界面(neomorphic surface),在这个特殊的界面上进一步做文(wén)章。
07 AI在分(fēn)子胶上的应用(yòng)?
l 目前是希望能(néng)够借助已有(yǒu)的分(fēn)子胶和蛋白底物(wù)的信息,再通过AI大数据學(xué)习的方式来找寻相关的规律,但目前积累的信息还是比较有(yǒu)限的。
【参考文(wén)献】
Dale B, Cheng M, Park KS, Kaniskan HÜ, Xiong Y, Jin J. (2021) Advancing targeted protein degradation for cancer therapy. Nat Rev Cancer, doi: 10.1038/s41568-021-00365-x.
Dong G, Ding Y, He S, Sheng C. (2021) Molecular Glues for Targeted Protein Degradation: From Serendipity to Rational Discovery. J Med Chem. 64(15):10606-10620. doi: 10.1021/acs.jmedchem.1c00895.
转载: BioSpark Group


